まれで不思議な病気、ランゲルハンス細胞組織球症(LCH)。専門家の少なさゆえに正しい診断・治療がなされにくい場合もあるLCHですが、適切な治療を行えば、しっかり治る症例が多いです。少しずつ、研究も進められてきています。
本記事では自治医科大学附属病院の森本哲先生に、LCHの治療について解説いただきました。前回の記事とあわせて、お読みいただければと思います。(いしゃまち編集部)
1.LCHは炎症性骨髄腫瘍
「ランゲルハンス細胞組織球症(LCH)の正体は何?」で、LCHが「炎症性骨髄腫瘍」であることを詳しくお話ししました。簡単にまとめますと、LCH細胞には発がん遺伝子に変異がありますが、一般の「がん」とは異なり、ほとんどの場合一つしか変異がありません。普通、その一つの変異だけでは「がん」の性質をもつことはありません。しかし、LCH細胞は白血球の一種である未熟樹状細胞の性質、つまり、外敵が侵入してきたときにそれを食べて免疫系を戦闘態勢にする性質を持っているので、様々な炎症細胞(攻撃部隊)を巻き込んで、延々と戦闘を続けるために戦場は荒れ果てる、すなわち臓器が傷んでしまうわけです。
LCH細胞と周りの炎症細胞は、互いに刺激し合いながら生き延びています。なので、LCHの治療に当たっては、腫瘍性のLCH細胞をやっつける抗腫瘍と、その周りを取り巻く炎症細胞をおとなしくさせる抗炎症の両方を考えた治療が必要になります。
2.どんな患者さんが治療対象になるの?
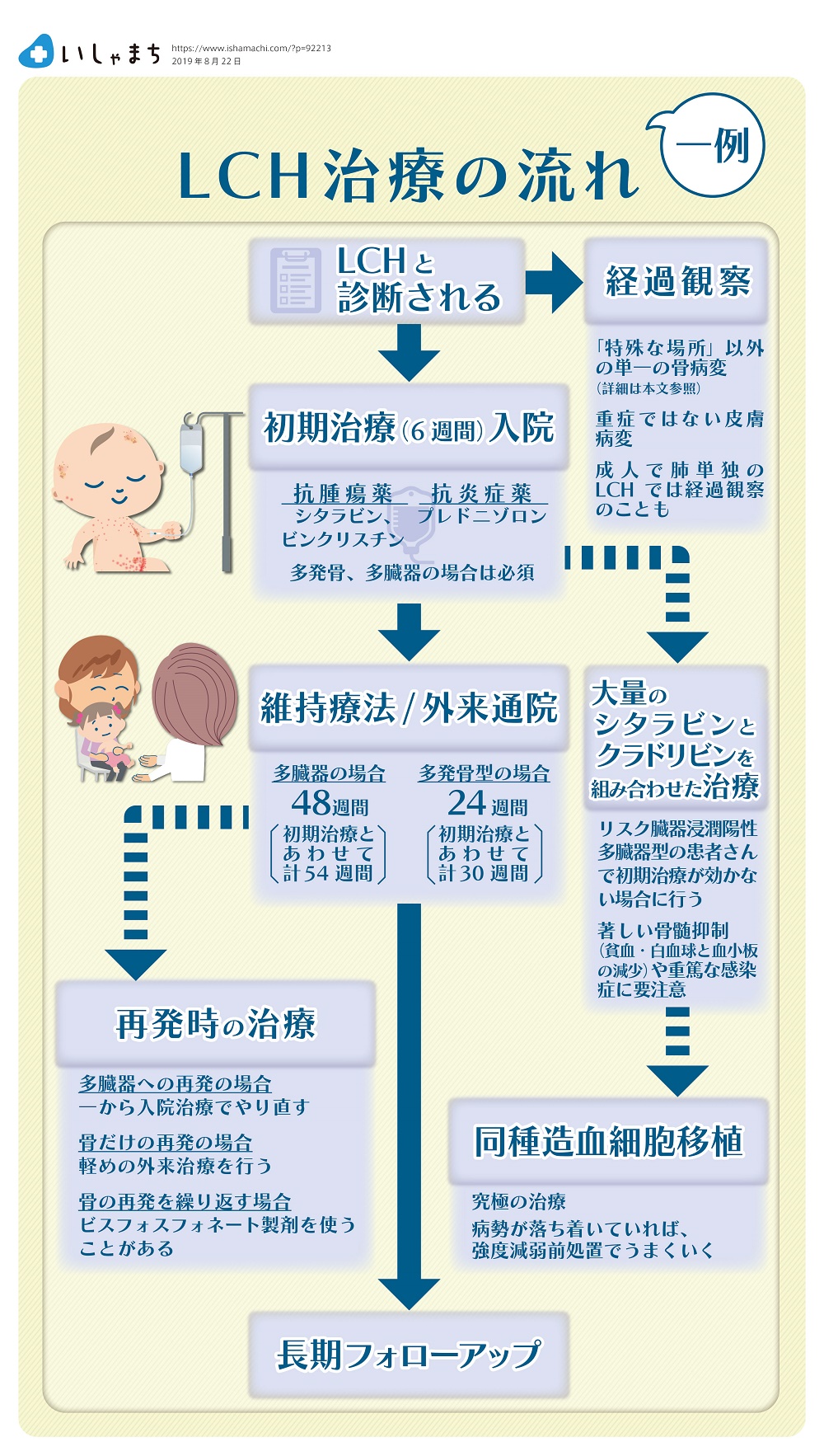
LCHは自然に治ることもあるので、すべてのLCH患者さんが抗腫瘍薬の治療の対象になるわけではありません。単一の骨病変で、眼や耳のまわり、顔の骨のほか、神経に影響するような背骨などの場合には、積極的に治療をしますが、部位がそれ以外で、痛みや腫れがさほどでもなければ、抗腫瘍薬の治療は行なわず経過を見ることがあります。また、皮膚のみ病変で、範囲が狭くジュクジュクしていない場合も抗腫瘍薬の治療をせず経過を見ることがあります。
一方、多発の骨病変、あるいは、多臓器に病変がある場合には、晩期合併症を伴うことが多いため、抗腫瘍薬の治療は必須です。
なお、成人でよくみられる肺単独のLCHについては、呼吸器内科の先生方は、ほとんど治療せず静観されます。LCHによって肺は破壊され肺嚢胞になります。肺嚢胞という状態まで進展してしまっている場合には、抗腫瘍薬を使っても副作用が出るだけで改善はしないので、積極的に治療をされないのだと思います。しかし、肺嚢胞に至る前の早期に治療を開始すると効果があるかもしれませんし、肺嚢胞になっている部分があっても残っている正常な肺を悪化させない効果はあるかもしれません。また、肺単独と思っていたら多臓器型に進展したというようなこともあります。肺単独のLCHを抗腫瘍薬によって治療するかどうかは、議論すべき課題です。
3.抗腫瘍と抗炎症治療
まず第一に注意していただきたいのは、現在、LCHに保険適応になっている薬は、後述するビンブラスチンしかないということです。日本でLCHに対して幅広く使われている薬は、ほとんどが保険適応外使用です。
ビンブラスチンは海外で承認されていたので、公知申請という方法によって、国内で治験をせずに保険適応が取れました。LCHが希少疾患で患者さんが少なく、かつ、LCHに対して使われる多くの薬は発売されてから長年経過している、すなわち薬価が安く儲けが少ないので、製薬会社は今更お金のかかる治験などやりません。なので、保険適応外使用といういびつな状態が続いています。
さてさて、気を取り直してLCHの治療戦略について考えてみましょう。
LCH細胞は、白血球の一種です。白血球は、大きく分けると骨髄系とリンパ系の2種類があります。急性白血病にも骨髄系のものとリンパ系のものがありますが、この2つでは、治療に使われる抗腫瘍薬がかなり違います。骨髄系の白血病の治療では、シタラビンやエトポシドという薬剤が主役です。一方、リンパ系の白血病には副腎皮質ステロイド(プレドニゾロンなど)とビンカアルカロイド(ビンクリスチンなど)などを主に使います。
LCH細胞は骨髄系細胞です。なので、LCH細胞に対しては、骨髄系に対する抗腫瘍薬を選ぶべきだと考えられます。そして、LCH細胞を取り巻く炎症細胞をおとなしくさせる抗炎症薬としては、副腎皮質ステロイドやビンカアルカロイドが有効だと考えられます。
エトポシドという骨髄系の腫瘍に使われる薬は、1990年代までLCHの治療に広く使われていました。そして効果も認められていました。しかし、エトポシドには二次性白血病という重大な副作用があり、エトポシドにより治療を受けたLCHの患者さんが急性前骨髄性白血病になってしまったという報告が相次ぎました(Kudo K, 1998)。二次性白血病が生じる頻度は1%ほどと高くはないのですが、このことがわかってから、LCHの治療にエトポシドが使われることは、ほとんどなくなりました。
1990年代から行われてきた国際組織球学会(Histiocyte Society)による国際臨床試験(Gadner H, 2001; 2008; 2013)の治療薬は、ビンブラスチンというビンカアルカロイドとプレドニゾロンが中心になっています。当初はエトポシドも組み込まれていましたが、前述のような理由から使われなくなりました。ビンブラスチンとプレドニゾロンという組み合わせは、炎症細胞をおとなしくさせる効果はあると考えられますが、LCH細胞を直接やっつける効果は乏しいと思われます。
1990年代初めにオランダのEgelerさんらが、シタラビンとビンクリスチン、プレドニゾロンの組み合わせが肝臓または脾臓・造血器に病変がある多臓器型(リスク臓器浸潤陽性多臓器型と呼びます)のLCHに有効ではないかと報告しました(Egeler MR, 1993)。そこで、日本LCH研究会では1996年から、多発の骨および多臓器型のLCHの患者さんを対象に、この3つの薬を中心とした30週間の臨床試験(JLSG-96)を開始しました。この治療によって、それまで20%近かった多臓器型LCHの患者さんの死亡率は5%まで低下し、劇的な効果が得られました(Morimoto A, 2006)。
しかし依然として、多臓器型の患者さんの半数は再発しました。そこで2002年からは、治療期間を54週間に延長した臨床試験(JLSG-02)を行い、これによって多臓器型の再発率は30%まで低下しました(Morimoto A, 2016)。この成績は、国際臨床試験よりも良好です。
開始当時は、まだLCHの正体が良くわかっていなかったのですが、今考えると、抗腫瘍と抗炎症の両方を目指した治療であり、先見の明があったということになります。
JLSG-02の治療内容は、日本LCH研究会のホームページ(http://www.jlsg.jp/)に掲載されています。
4.初期治療が効かないときはどうするか?
リスク臓器浸潤陽性多臓器型の患者さんの場合、前述のシタラビン/ビンクリスチン/プレドニゾロンによる治療を6週間行っても、約1/4の患者さんは、良くなりません。このような患者さんの30%は亡くなってしまいます。
初期治療でよくならない、リスク臓器浸潤陽性多臓器型の患者さんに対しては、大量シタラビンとクラドリビンを組み合わせた治療(Donadieu J, 2015)が試みられています。この治療により、初期治療(この場合ビンブラスチン+プレドニゾロン)が効かなかった患者さんの90%以上で効果が得られたと報告されています。しかし、著しい骨髄抑制(貧血・白血球と血小板の減少)の副作用がありますので、安易には行えません。
究極の治療として、同種造血細胞移植があります。LCH細胞は血液由来の細胞なので、血液をまるごと入れ替えようというわけです。移植前に病勢が落ち着いている状態であれば、強度減弱前処置(RIC)※でも十分うまくいきます。しかし、病勢が落ち着いていない、すなわち、免疫系が活発になりすぎている状態で移植をしても、拒絶や臓器障害がおきてしまい、移植がうまくいかないことがしばしばあります。
※移植を行う際、患者さんの体内のがん細胞をできるだけ少なくするため、また、提供者の造血細胞を患者さんの体に定着させるために、1週間ほど前から、抗腫瘍薬や全身放射線照射など用いた処置(前処置)を行います。強度減弱前処置は、副作用の軽減を図るために、従来よりも前処置の強度を弱めたものです。
5.再発時の治療はどうするか?
LCHはしばしば再発する病気です。再発しても、ほとんどの場合は治療が効いてよくなります。でもまた再発することもあります。再発部位は多くが骨です。多臓器に再発した場合には、一から治療をやり直すことがありますが、骨だけの再発の場合には、通院で可能な軽めの治療を選ぶことが多くなります。頻回に骨に再発する例には、ビスフォスフォネート製剤という破骨細胞を抑える薬が使われることがあります(Morimoto A, 2011)。
6.分子標的治療はどうでしょう?
約半数の患者さんには、LCH細胞にBRAF遺伝子の発がん性変異があります。しばしばBRAF遺伝子に変異を認める悪性黒色腫では、BRAF遺伝子の働きを抑える内服薬(ベムラフェニブなど)が実際に治療に使われています。
LCHでも、抗腫瘍薬による治療が効かないBRAF変異陽性のリスク臓器浸潤陽性多臓器型の患者さんに、ベムラフェニブを内服したところ症状が良くなったという報告があります。今までにBRAF変異陽性の小児LCHにベムラフェニブ使った報告は10例ほどあり、ほとんどすべての例で大きな副作用なく効果が得られています(Heisig A, 2018)。しかし、何か月かで薬を止めた患者さんはすべて再発しており、どのくらいの期間飲み続けなくてはいけないのかがわかっていません。
ベムラフェニブは、造血細胞移植をする前に病勢を安定させるのに適した治療法と思われます。現在海外でLCHに対するベムラフェニブの治験が行われていますが、薬の承認はまだ先になりそうです。
7.今後の臨床試験はどうなるの?
LCHの治療はこの四半世紀で大きく進歩しました。これは、よりよい治療を目指して、臨床試験が積み重ねられてきた結果です。今残されている課題としては、下記の三点が挙げられると思います。
- リスク臓器浸潤陽性多臓器型で初期治療反応不良例の死亡率が高いので、初期治療の奏功率を上げるにはどうしたらよいか?
- 重大な晩期合併症である中枢性尿崩症や中枢神経変性症を減らすにはどうしたらよいか?
- 再発が未だ多いので、その多くを占める骨再発を減らすにはどうしたらよいか?
これらを解決するため以下の仮説を立てて、臨床試験を計画中です。
1)初期治療の奏功率を上げるには
初期治療の強化が考えられます。しかし、抗腫瘍薬を強くしすぎると副作用が大きな問題になります。このような例では、過剰な炎症による臓器障害が死因になることが多いので、抗炎症を強化するほうが、理にかなっているように思われます。そこで、一般に使われるプレドニゾロンを、より抗炎症効果が高いデキサメタゾンに入れ替えれば、初期治療反応が良くなるのではと考えています。
2)中枢性尿崩症や中枢神経変性症を減らすには
中枢神経を標的とした治療を導入すべきと考えています。脳は脳血液関門というバリアによって、抗腫瘍薬などの化学物質から守られています。言い換えれば、脳の中は抗腫瘍薬が届きにくく、治療効果が十分でないということになります。
最近、LCH細胞と同じ発がん性遺伝子を持った骨髄系細胞(マクロファージ)によって中枢神経変性症が引き起こされるということがわかってきました。急性白血病では、白血病細胞が脳の中に広がり再発することがあるため、髄腔内注射と言って脳脊髄液へ抗腫瘍薬を注入する治療が当たり前ですが、LCHではこのような治療は全く行われてきませんでした。脳内の発がん性遺伝子変異を持った細胞をやっつけるため、LCHでも髄腔内注射を取り入れれば、中枢神経関連の晩期合併症を減らせるのではないかと思います。
3)骨再発を減らすには
ビスフォスフォネート製剤の効果に期待します。再発時に使った場合、2回目以降の再発よりも初回再発のほうがより効果が高いといわれていますので、再発する前から使えばより効果が高くなるのではと期待します。まずは、多発の骨病変のある患者さんから試そうと考えています。
これらの仮説は臨床試験によって検証されねばなりません。昨年施行された臨床研究法により、臨床試験を行うには何千万単位の莫大な資金が必要になりました。現在、研究資金の獲得に努力しているところです。